
很明显,在过去几年里,医学尤其受益于增材制造。除了生产口罩、假肢、矫形器甚至教育材料外,对药品印刷的投资也在增加。参与其中的一家公司是中国3D打印药物制造商Triastek股份有限公司。自2015年成立以来,除了剂型设计之外,他们一直致力于数字医药产品开发和智能制造,所有这些都是为了公众的利益。现在,Triastek已获得美国食品药品监督管理局(FDA)的IND(研究性新药)申请批准,其3D制造的药物T21将用于治疗溃疡性结肠炎。
溃疡性结肠炎是最常见的慢性炎症性肠病之一。受影响的人患有大肠炎症,也会导致严重的压力和生活质量下降。Triastek的药物T21已获得IND批准,因此可以迈出在美国开始临床试验的第一步。
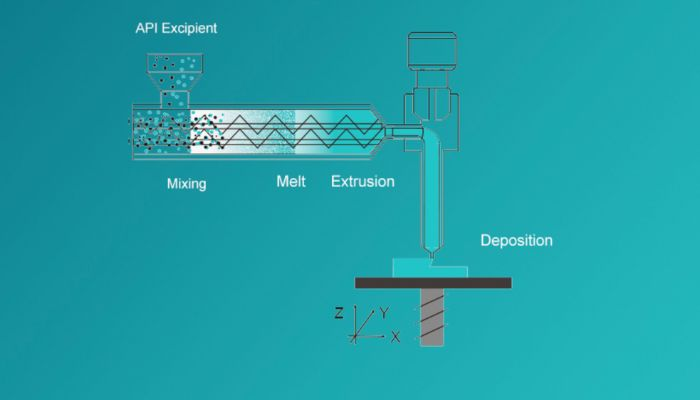
T21药物是如何产生的?
这里使用的3D打印技术是通过熔融挤压沉积(MED®)的方式工作的,在这种方法中,粉末状的起始材料总是处于柔软或熔融状态。然后,开始一层接一层的应用,直到最终可以实现3D打印的药物T21。增材制造的特殊功能是针对结肠靶向递送药物。在这里,药物可以靶向胃肠道的大肠段,从而在保持相同效果的同时也能够降低药物剂量。此外,Triastek因此能够在药物开发的早期阶段使用放射性成像剂。这意味着可以评估药物在胃肠道内的释放部位。最终,这意味着未来的药物可以靶向胃肠道内的特定片段,并提供更高的效率和成功率。最后,该公司进一步宣布,这项技术不仅可以用于口服缓释片,而且对肽类药物的进一步研究也非常有帮助。
“我们很高兴能获得IND批准,开始为患者进行这种潜在的变革性治疗的临床试验。郑森平,Triastek创始人兼首席执行官。“延迟药物释放并将口服剂型输送到结肠是一项具有挑战性的工作,因此T21通过提供特定部位的药物输送和局部药物作用,减轻全身暴露的潜在副作用,为患者提供了一种有前途的新选择。我们期待着将这种治疗方法推广到临床,并感谢美国食品药品监督管理局的支持。”

你可能已经听说过Triastek过去在增材药物制造方面的突破,因为它们还获得了T19和T20药物的IND批准,分别用于治疗类风湿性关节炎和心血管和凝血障碍。
